Archiv Detail
Aus einzelnen Zellen auf den ganzen Fisch schliessen
7. August 2015 |
Pro Jahr werden allein im EU-Raum über eine Million Fische für toxikologische Tests und Forschungszwecke eingesetzt, für einen einzigen Chemikalien-Test zum Fischwachstum rund 400 Fische. Umweltbehörden verlangen vor der Zulassung neuer Chemikalien oft solche Tests, da das Wachstum über die frühen Lebensstadien sehr empfindlich auf eine Belastung des Wassers mit Schadstoffen reagiert. Immer mehr Versuchstiere einzusetzen, ist jedoch ethisch fragwürdig. Ausserdem sind die Tests aufwändig, teuer und dauern Wochen bis Monate. Daher suchen Forschung, Behörden und Industrie schon länger nach neuen Wegen. Ein Projekt an der Eawag, zusammen mit den beiden ETHs in Zürich und Lausanne sowie mit der Universität York (GB), zeigt einen solchen Weg auf. Jetzt wurden die Resultate in der Zeitschrift Science Advancesfile:///D:/Users/Koebi/Downloads/EawagNews-zellen-statt-fische_DE.docx#_edn1 publiziert: Statt mit lebenden Fischen (in vivo) werden die Versuche mit Fischzellen (in vitro) im Labor gemacht. Nach nur fünf Tagen zeigen die je nach Chemikalienbelastung schneller oder langsamer angestiegenen Zellzahlen – kombiniert mit der Hochrechnung in einem Computermodell – eine verblüffend gute Übereinstimmung zu den unabhängig durchgeführten Versuchen mit Fischen.
Täglich 15'000 neue Chemikalien
Soeben wurde beim „Chemical Abstracts Service“ die 100 Millionste Chemikalie international mit einer Nummer registriert. Täglich kommen gegen 15‘000 neue Substanzen dazu. Für die wenigsten davon existieren verbindliche Regulierungen. Für noch weniger wurden Sicherheits- und Umwelttests durchgeführt. Jährlich durchlaufen lediglich rund 10 neue Substanzen, die in grossen Mengen produziert werden, ein seriöses Testverfahren. Allein um die Chemikalien-Zulassungs-Richtlinie REACH (Registration, Evaluation, Authorisation and Restriction of Chemicals) der EU zu erfüllen müssten eigentlich 300 mal mehr Stoffe getestet werden. Denn das Ziel der Risikobewertungen ist es, Umweltbelastungen vorzubeugen. Nur so kann zwischen dem Nutzen eines synthetischen Stoffes für Mensch und Wirtschaft und dem Risiko für die Ökosysteme eine Balance gefunden werden.
Umwelttoxikologin Prof. Kristin Schirmer leitet die Arbeiten zum Ersatz von Tierversuchen an der Eawag. Für sie steht fest: «Das ist ein grosser Schritt hin zu einfacheren, günstigeren und schnelleren Testverfahren für die Zulassung und Anwendung neuer Chemikalien. Es ist das erste Mal, dass wir von Zellkulturen sehr treffsicher auf Effekte an Tieren schliessen konnten, die im Tier erst nach Wochen oder gar Monaten sichtbar werden.» Der Mechanismus hinter dem neuen Verfahren scheint einfach: Die in der Studie eingesetzten Pestizide hemmen das Wachstum der Fische. Je höher die Konzentrationen im Wasser sind, umso kümmerlicher wachsen die Tiere. Dieselben Effekte wiesen die Forschenden mit der Anzahl der im Labor kultivierten Kiemenzellen nach. «Das Übertragen der Resultate klappt deshalb so gut», so Kristin Schirmer, «weil grössere Fische nicht aus grösseren, sondern schlicht aus mehr Zellen bestehen und weil wir die Konzentration der Chemikalie in den Zellen berechnen.» Das Modell sagt also voraus, was passiert, wenn der Fisch die getestete Chemikalie im Wasser antrifft – das hilft, andere Tests und Vorhersagemodelle zu verbessern.
Ganz so simpel ist der neue Ansatz allerdings dann doch nicht. Bis klar ist, welche Konzentrationen bei den verwendeten Zellen dieselben Effekte haben wie bei den lebenden Fischen, sind Berechnungen am Computer nötig und man muss die Eigenschaften der Substanzen möglichst gut kennen. Zudem ist noch offen, ob sich die Kiemenzellen als «Indikatoren» für alle Gewebe im Fisch bewähren. Möglicherweise reagieren andere Zellen anders oder die getesteten Chemikalien werden in ihnen biologisch umgebaut. Das Interesse der Fachwelt an der Studie ist dennoch gross, denn sie folgt einem neuen Denkansatz. Dr. Roman Ashauer, welcher die Studie initiierte und mittlerweile an der University of York in England forscht und lehrt, erklärt: «Bisher werden Chemikalientests nach dem Motto ‚erst einmal testen und dann interpretieren‘ durchgeführt. Wir gehen einen neuen Weg, indem wir zuerst ein relativ einfaches mathematisches Modell vom Fischwachstum für unsere Fragestellung modifizieren und dieses Modell dann gezielt mit den nötigen experimentellen Daten versorgen.» Die Autoren hoffen, dass andere Forscher das Potential dieses Ansatzes nutzen, um seine Einsatzbreite zu testen. Die Zeichen stehen gut dafür: Die Erstautorin der Studie, Dr. Julita Stadnicka-Michalak, wurde von der europäischen Gesellschaft für Umwelttoxikologie und -chemie (SETAC Europe) an der Jahreskonferenz in Glasgow mit dem renommierten Young Scientist Award ausgezeichnet.
Originalartikel
Toxicology across scales: cell population growth in vitro predicts reduced fish growth; Julita Stadnicka-Michalak, Kristin Schirmer, Roman Ashauer (2015); Science Advances. DOI: 10.1126/sciadv.1500302
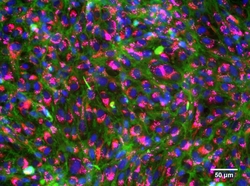
Angefärbte, gesunde Kiemenzellen von Regenbogenforellen: Zellkerne (blau), Membranen (grün), Mitochondrien (rot), Lysosome (pink).
(© Foto: Vivian Lu Tan, Eawag)
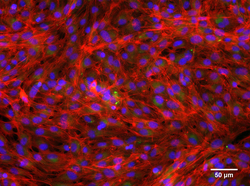
Angefärbte, gesunde Kiemenzellen von Regenbogenforellen: Zellkerne (blau), Lipide (grün), Aktin (rot).
(© Foto: Vivian Lu Tan, Eawag)
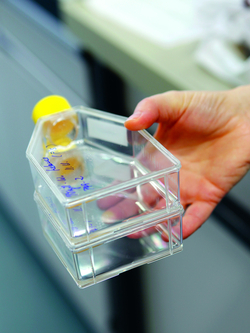
In solchen 24er Wellplatten werden die Kiemenzellen verschiedenen Konzentrationen der Chemikalien ausgesetzt und danach auf ihre Vitalität überprüft.
(© Foto: Julian Salinas, ETH-Rat)